Eén van de belangrijke doorbraken bij de behandeling van HER2+ borstkanker is ongetwijfeld de ontwikkeling geweest van monoklonale antilichamen zoals trastuzumab en bevacizumab, die met grote precisie therapeutische targets viseren, ondanks de hoge kost voor de sociale zekerheid. Geen enkele zorgverlener stelt dan ook de opportuniteiten in vraag die verbonden zijn aan de ontwikkeling van biosimilars, goedkoper geproduceerde varianten van therapeutische eiwitten.
Trastuzumab definieert nieuwe therapeutische standaarden, maar…
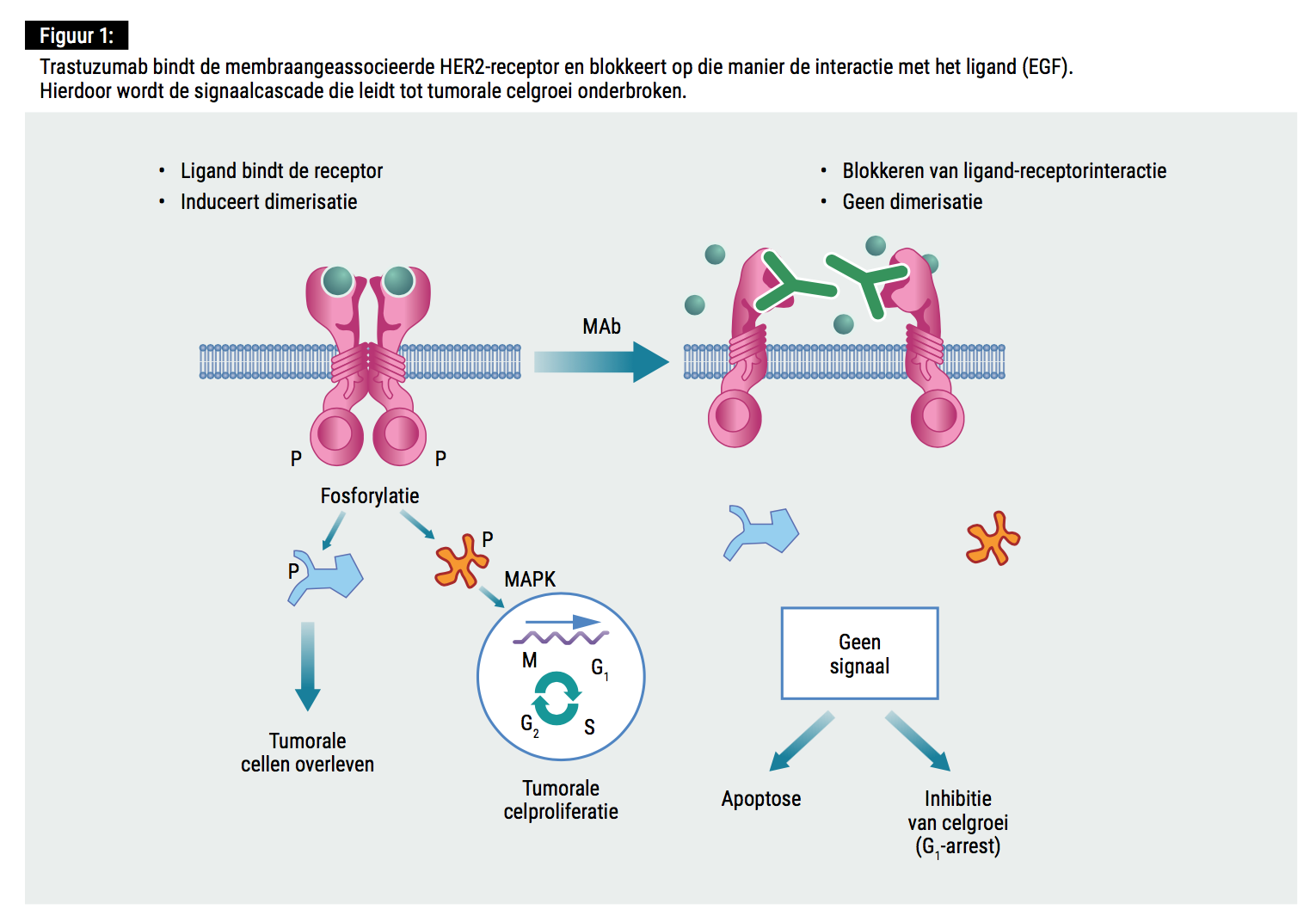
Hoewel het afgelopen decennium de mortaliteit voor borstkanker significant gedaald is – niet in het minst dankzij het bewandelen van nieuwe therapeutische paden – blijft borstkanker één van de belangrijkste kankergerelateerde doodsoorzaken wereldwijd (1). In HER2+ kanker is het gen coderend voor epidermal growth factor receptor 2 (HER2) geamplificeerd, waardoor het HER2-eiwit tot pathologische overexpressie gebracht wordt, hetgeen tot ongecontroleerde celgroei leidt. Het recombinante, gehumaniseerde monoklonale antilichaam (MAb) trastuzumab (Herceptin®) viseert dit membraangeassocieerde HER2-eiwit, dat interageert met epidermal growth factor (EGF), en inhibeert op die wijze de signaalcascade die tot celgroei en differentiatie (én tumorvorming) leidt (2).
Anno 2000 verkreeg trastuzumab de EMA-goedkeuring ter behandeling van gemetastaseerde HER2+ borstkanker. Een jaar later werd trastuzumab goedgekeurd als adjuvante en non-adjuvante therapie ter behandeling van vroege HER2+ borstkanker (3). Inmiddels zal niemand nog betwisten dat trastuzumab nieuwe therapeutische standaarden heeft gedefinieerd ter behandeling van patiënten met vroege of geavanceerde HER2+ borstkanker en het monoklonale antilichaam bevindt zich inmiddels op de WHO-lijst van essentiële geneesmiddelen.
… de behandelingskost blijft hoog
Hoewel trastuzumab inmiddels de standard of care is voor patiënten met vroege of geavanceerde HER2+ borstkanker, kan men de resultaten van real world-studies niet naast zich neerleggen, namelijk dat 12-50% van deze patiënten (in de USA, Europa en China) geen trastuzumab toegediend kreeg tijdens (bepaalde fasen van) het behandelingstraject (4). Dergelijke barrières zijn ongetwijfeld multifactorieel, afhankelijk van de precieze klinische setting en patiëntenpopulaties, maar vele zorgverleners zijn de mening toegedaan dat in niet weinige gevallen de behandelingskost van een trastuzumabtherapie mee een bepalende factor is.
In deze context is het dan ook verre van onbelangrijk dat het patent van trastuzumab in Europa vervallen is sinds 2014 en in de USA zal aflopen in 2019, hetgeen perspectieven opent voor het ontwikkelen van biosimilars. Ter herinnering: biosimilars zijn biologische producten die geacht worden gelijkwaardig zijn aan het therapeutische eiwit (hetgeen niet betekent dat ze identiek zijn).
Trastuzumab-biosimilars
voor HER2+ borstkanker
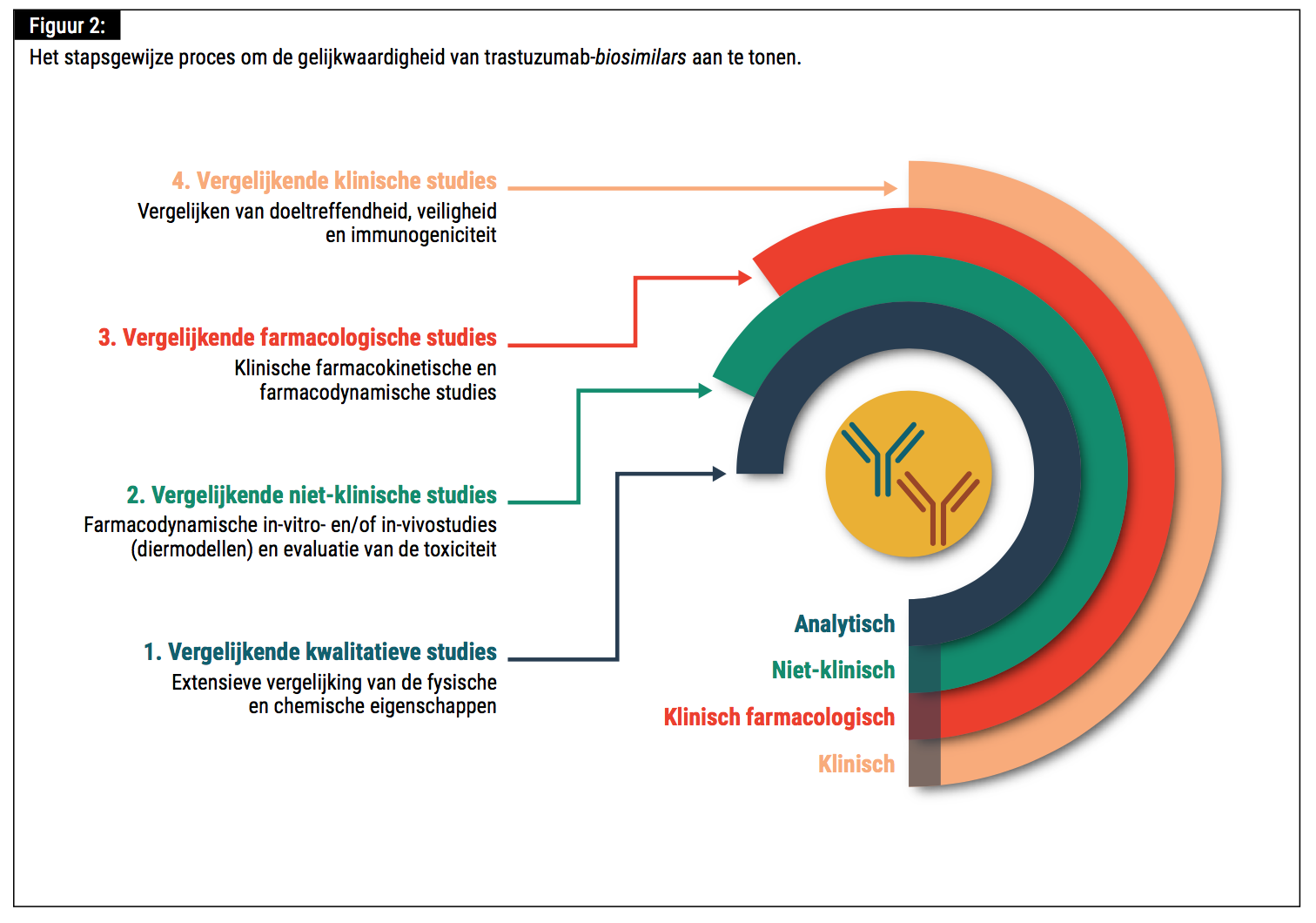
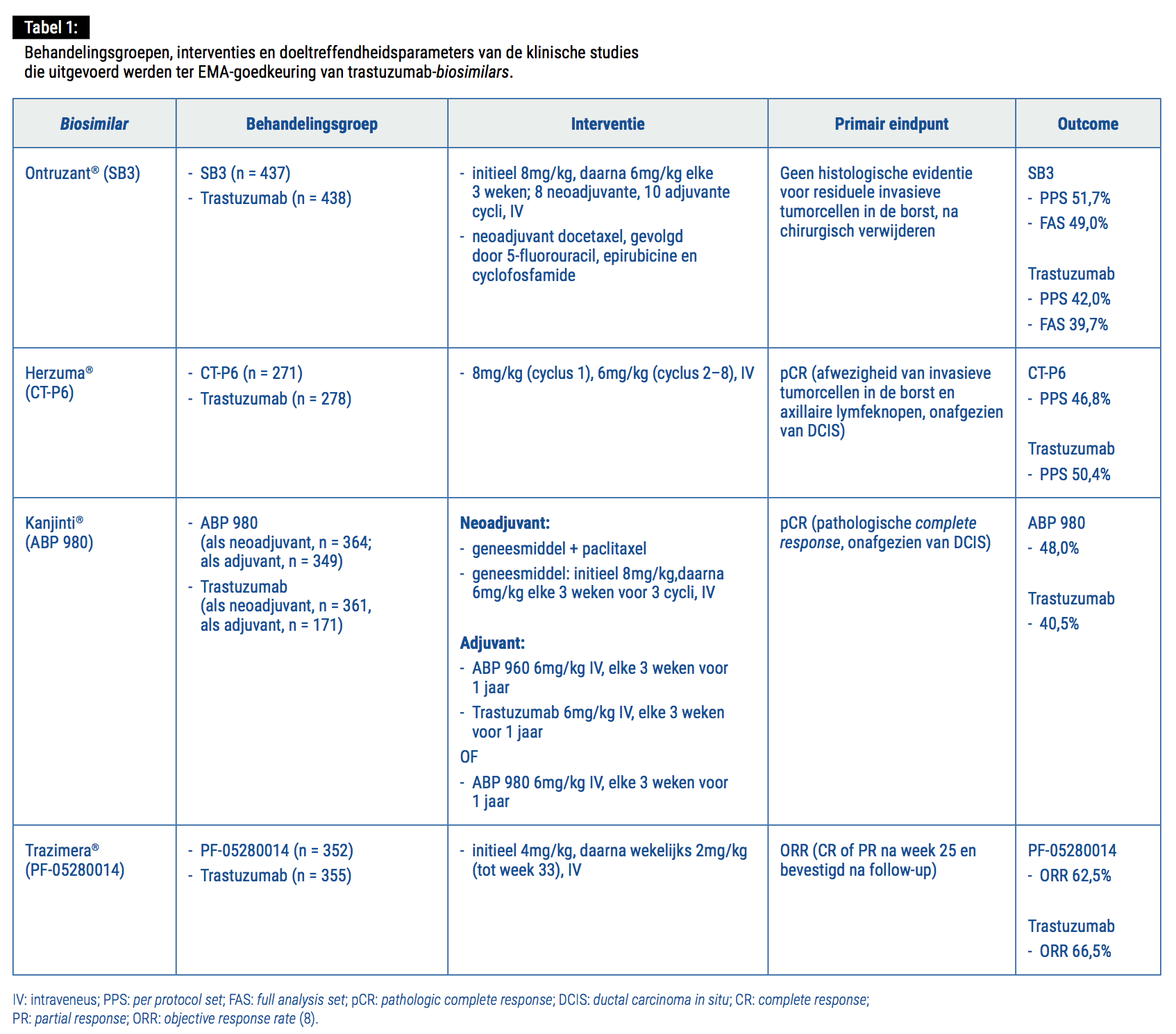
Het doeltreffendheids- en veiligheidsprofiel van trastuzumab-biosimilars werd (in een head-to-head setting met het referentieproduct) aangetoond in gerandomiseerde, dubbelblinde fase III-trials. In deze studies werden primaire eindpunten gedefinieerd als het aantal patiënten met een pathologische complete respons (pCR) – gedefinieerd als de afwezigheid van invasieve tumorcellen in de borst en in de axillaire lymfeknopen – in de neoadjuvante setting en overall response rate (ORR) bij metastase. Secundaire eindpunten varieerden tussen de verschillende studies, maar omvatten additionele bepalingen van de doeltreffendheid, zoals event-free, progression-free en overall survival, samen met een evaluatie van de veiligheid en de immunogeniciteit van de desbetreffende biosimilar.
Inmiddels hebben de volgende trastuzumab-biosimilars EMA-goedkeuring gekregen:
- Ontruzant® (SB3, Samsung Bioepis) is de eerste trastuzumab-biosimilar die goedkeuring verkreeg in Europa, namelijk in november 2017. Klinische studies hebben aangetoond dat SB3 een evenwaardig doeltreffendheids- en veiligheidsprofiel en een vergelijkbare tolerabiliteit en immunogeniciteit vertoont als het referentieproduct. SB3 verkreeg bijgevolg EMA-goedkeuring voor alle trastuzumab-indicaties, d.w.z. vroege en gemetastaseerde HER2+ borstkanker en HER2+ gemetastaseerde maagkanker (5).
- Herzuma® (CT-P6, Celltrion/Teva) verkreeg EMA-goedkeuring in februari 2018 voor alle trastuzumab-
indicaties (6).
- Kanjinti® (ABP 980, Amgen) verkreeg EMA-goedkeuring in maart 2018 voor alle trastuzumab-indicaties. Zeer recent werden de resultaten van de dubbelblinde, multicenter-, fase III-LILAC-studie gepubliceerd, waarbij vrouwen met vroege, invasieve HER2+ borstkanker werden gerandomiseerd naar ABP 980 (n = 358)
of trastuzumab (n = 338). Het primaire eindpunt,
namelijk pathologische complete response (pCR), werd bereikt bij 172 (48%) van de patiënten in de ABP 980-arm versus 137 (42%) in de trastuzumab-arm. Adverse events (> graad 3) tijdens de neoadjuvante fase werden geregistreerd bij 15% van de patiënten in de ABP 980-arm versus 14% in de trastuzumab-arm: neutropenia (meest genoteerd > graad 3-adverse event) werd waargenomen bij 6% van de patiënten in beide cohorten (7).
- Trazimera® (PF-05280014, Pfizer) verkreeg EMA-goedkeuring in mei 2018 voor alle trastuzumab-indicaties. De resultaten van de fase III-REFLECTIONS-studies bij patiënten met HER2+ gemetastaseerde borstkanker tonen een overall response rate (ORR) van 62,0% voor Trazimera®, in vergelijking met 66,5% voor trastuzumab, alsook een gelijk(w)aardig veiligheidsprofiel en een gelijkaardige incidentie van adverse events.
Hierbij dient opgemerkt te worden dat deze biosimilars enkel intraveneus toegediend worden, terwijl trastuzumab zowel intraveneus als subcutaan kan worden toegediend. Het kan m.a.w. afhankelijk zijn van de precieze klinische setting of een biosimilar dan wel het referentieproduct ingezet wordt (9). Insiders verwachten bovendien dat bovenvermelde lijst jaarlijks zal worden uitgebreid met andere trastuzumab-biosimilars die EMA-goedkeuring zullen verkrijgen. Inderdaad, fase III-studies waarbij andere trastuzumab-biosimilars worden geëvalueerd, werden opgezet of zijn reeds afgesloten.